|
Khái niệm
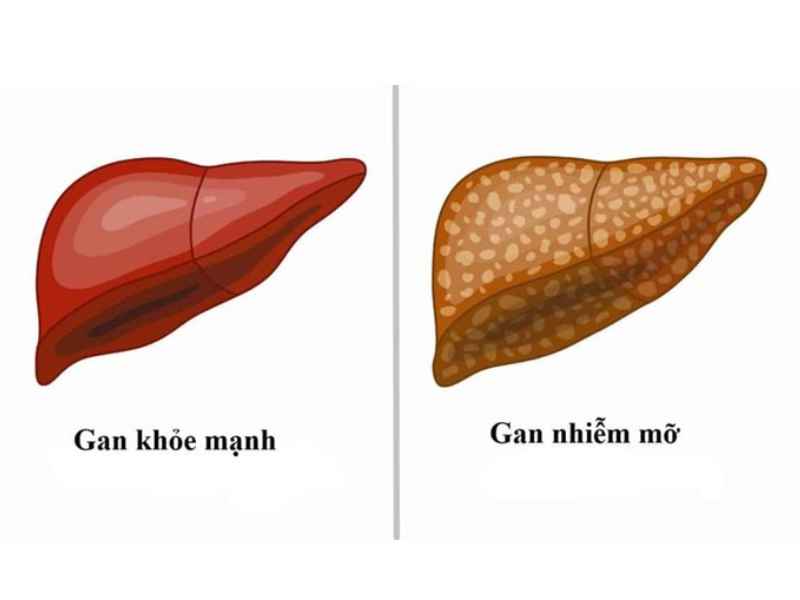
Gan nhiễm mỡ không do rượu (NAFLD) là tình trạng tích lũy mỡ trong gan chiếm ít nhất 5% khối lượng gan, không liên quan đến việc tiêu thụ rượu. Đây là một trong những bệnh lý gan phổ biến nhất hiện nay, ảnh hưởng đến hơn 25% dân số toàn cầu. NAFLD được coi là nguyên nhân hàng đầu gây bệnh gan mạn tính, với tầm ảnh hưởng lớn đến sức khỏe cộng đồng.
Danh pháp
Chỉ có tích lũy mỡ trong gan, không có dấu hiệu viêm hoặc tổn thương tế bào gan. Đây là dạng không tiến triển của gan nhiễm mỡ không do rượu và thường ít gây hậu quả nghiêm trọng.
Là dạng nặng hơn của NAFLD, kèm theo viêm gan, tổn thương tế bào gan (như hiện tượng tế bào phồng to, hoặc “ballooning”), và/hoặc xơ hóa. NASH có thể tiến triển thành xơ gan, thậm chí ung thư gan.
Metabolic dysfunction-associated fatty liver disease (MAFLD) được đề xuất thay thế bệnh gan nhiễm mỡ không do rượu nhằm nhấn mạnh mối liên quan chặt chẽ giữa bệnh gan này và các yếu tố hội chứng chuyển hóa. Thuật ngữ mới này bao gồm cả những bệnh nhân có tổn thương gan do các yếu tố chuyển hóa, mở rộng tiêu chí chẩn đoán và khả năng điều trị.
Biểu đồ: Sự khác biệt giữa NAFL và NASH qua các giai đoạn tiến triển bệnh
| Giai đoạn | Gan nhiễm mỡ không do rượu | Viêm gan nhiễm mỡ không do rượu |
| Steatosis (Mỡ hóa) | Có tích lũy mỡ trong gan | Có tích lũy mỡ, kèm theo viêm và tổn thương tế bào |
| Viêm | Không | Hiện diện |
| Tổn thương tế bào | Không | Có (ballooning, apoptosis) |
| Xơ hóa | Không hoặc rất ít | Có thể tiến triển đến xơ hóa nặng hoặc xơ gan |
Bảng so sánh: Gan nhiễm mỡ không do rượu và Gan nhiễm mỡ do rối loạn chuyển hoá
| Tiêu chí | Gan nhiễm mỡ không do rượu | Gan nhiễm mỡ do rối loạn chuyển hoá |
| Tiêu chí chẩn đoán | Ít nhất 5% tế bào gan tích lũy mỡ, loại trừ nguyên nhân thứ phát như rượu, viêm gan virus. | Tích lũy mỡ kèm theo ít nhất một yếu tố hội chứng chuyển hóa. |
| Tầm quan trọng lâm sàng | Tập trung vào loại trừ các nguyên nhân khác của bệnh gan. | Nhấn mạnh mối tương quan giữa bệnh lý gan và hội chứng chuyển hóa. |
| Hướng điều trị | Quản lý nguyên nhân cơ bản, kiểm soát cân nặng. | Tăng cường kiểm soát các yếu tố chuyển hóa như béo phì, tiểu đường. |
Ngoài ra còn có một số danh pháp khác như:
Rối loạn dung nạp glucose
Rối loạn dung nạp glucose được biểu hiện qua hai giai đoạn trung gian giữa kiểm soát glucose bình thường và tiểu đường:
Kháng insulin
Béo phì
Béo phì là tình trạng tích tụ mỡ cơ thể vượt mức, gây hại cho sức khỏe.
Chỉ số khối cơ thể (BMI):
Béo bụng (Central Obesity): Được đo qua vòng eo, với ngưỡng giới hạn khác nhau theo chủng tộc:
Gan nhiễm mỡ không béo phì (Lean NAFLD)
Tỷ lệ mắc bệnh:
Biểu đồ: Tỷ lệ mặc gan nhiễm mỡ không do rượu trên thế giới
Mối tương quan với hội chứng chuyển hóa:
Gan nhiễm mỡ không do rượu đang ngày càng trở thành một vấn đề y tế quan trọng trên toàn cầu. Khi tỷ lệ mắc bệnh gan nhiễm mỡ không do rượu tăng cao, những biến chứng nghiêm trọng của bệnh, bao gồm xơ gan, suy gan và ung thư gan (HCC), cũng gia tăng nhanh chóng. Điều này làm tăng gánh nặng chi phí điều trị và chăm sóc sức khỏe. Do đó, việc phát hiện sớm và can thiệp kịp thời cho những bệnh nhân có nguy cơ bị bệnh gan nhiễm mỡ không do rượu tiến triển là rất quan trọng.
3.1. Tầm Quan Trọng Của Việc Khảo Sát Bệnh gan nhiễm mỡ không do rượu
Theo các nghiên cứu gần đây, bệnh gan nhiễm mỡ không do rượu hiện là nguyên nhân thứ hai dẫn đến bệnh gan mạn tính trong số các bệnh nhân cần ghép gan tại Hoa Kỳ, và tỷ lệ mắc bệnh này đã tăng gấp đôi từ năm 2004 đến 2013. Dự báo rằng chi phí điều trị gan nhiễm mỡ không do rượu sẽ chiếm một phần lớn trong tổng chi phí chăm sóc sức khỏe, với ước tính 103 tỷ USD vào năm 2016. Với sự gia tăng của bệnh, nhu cầu phát hiện và điều trị sớm bệnh nhân bệnh gan nhiễm mỡ không do rượu càng trở nên cấp thiết để ngăn ngừa các biến chứng nguy hiểm.
Tuy nhiên, hiện nay vẫn chưa có sự đồng thuận toàn cầu về việc thực hiện sàng lọc thường xuyên cho bệnh gan nhiễm mỡ không do rượu, mặc dù nhiều tổ chức y tế quốc tế như USPSTF (United States Preventive Services Task Force) và NICE (National Institute for Health and Care Excellence) không đưa ra khuyến nghị cho hoặc chống lại việc sàng lọc đại trà cho bệnh gan nhiễm mỡ không do rượu.
3.2.1. Triệu chứng lâm sàng
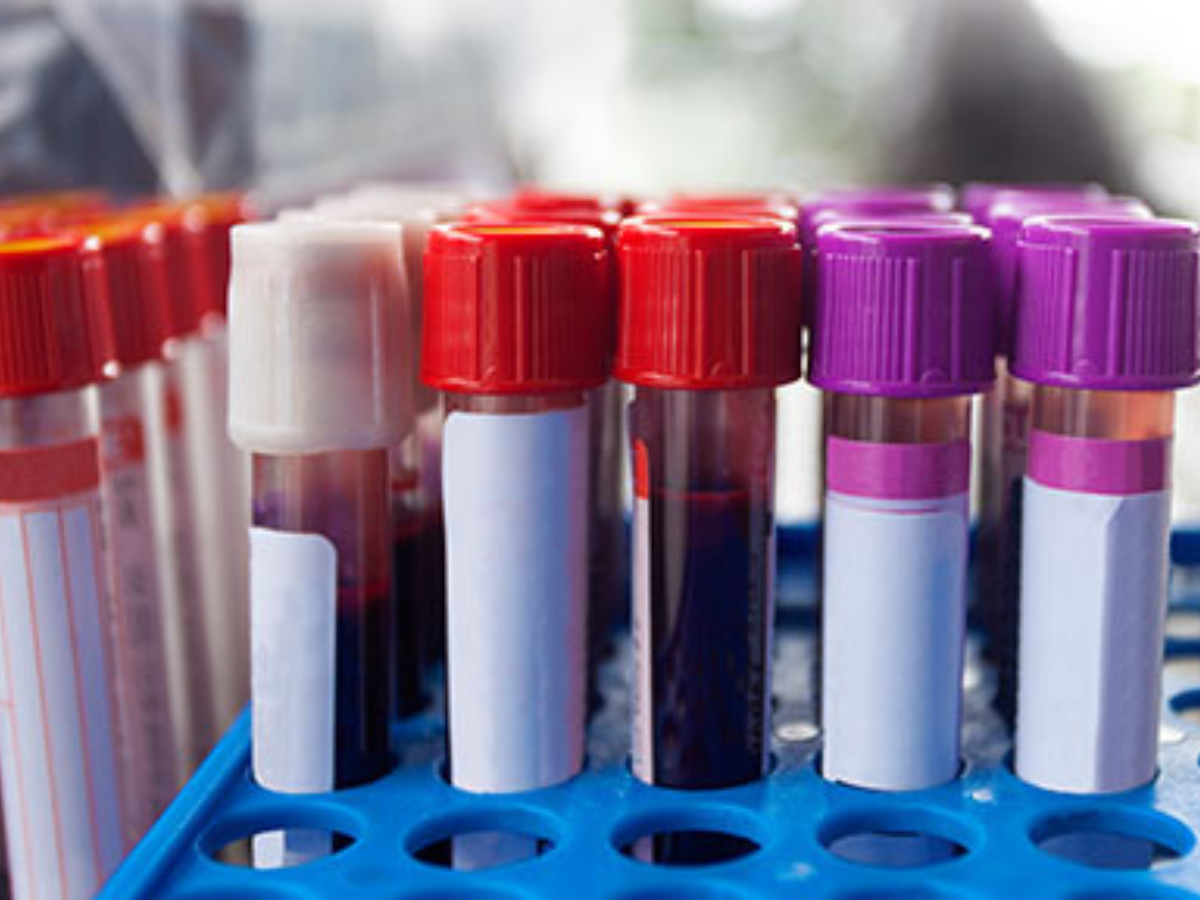
Phương pháp đơn giản nhất để phát hiện gan nhiễm mỡ không do rượu là thông qua các xét nghiệm máu để đo nồng độ các enzyme gan (aminotransferases). Mức độ cao của các enzyme này có thể chỉ ra tổn thương gan, đặc biệt là trong trường hợp có các yếu tố nguy cơ như đái tháo đường type 2 (T2DM), hội chứng chuyển hóa, hoặc béo phì.
Gan nhiễm mỡ không do rượu (NAFLD) là một trong những bệnh lý gan phổ biến, đặc biệt là trong những năm gần đây, khi tỷ lệ bệnh nhân mắc bệnh gan mỡ đang tăng cao. Một trong những thách thức lớn trong việc quản lý gan nhiễm mỡ không do rượu là phát hiện sớm bệnh và đánh giá mức độ tiến triển của nó. Việc sử dụng các xét nghiệm máu là một công cụ hữu hiệu để nhận biết và phân tầng nguy cơ của bệnh, từ đó đưa ra các phương án điều trị phù hợp.
3.2.1.1. Các Phương Pháp Sàng Lọc Bằng Xét Nghiệm Máu
Có một số phương pháp xét nghiệm máu nổi bật được sử dụng để đánh giá nguy cơ tiến triển của gan nhiễm mỡ không do rượu, bao gồm FIB-4, NAFLD Fibrosis Score (NFS) và Enhanced Liver Fibrosis (ELF). Các phương pháp này giúp phân loại mức độ xơ hóa của gan và dự đoán khả năng bệnh tiến triển thành xơ gan hoặc ung thư gan (HCC).
FIB-4 (Fibrosis-4 Index)
FIB-4 là một công cụ xét nghiệm máu đơn giản, kết hợp các yếu tố như tuổi, nồng độ AST (aspartate aminotransferase), ALT (alanine aminotransferase) và số lượng tiểu cầu trong máu. Ban đầu, FIB-4 được sử dụng để đánh giá mức độ xơ hóa ở bệnh nhân viêm gan C, nhưng sau đó, nó đã được xác nhận là có hiệu quả trong việc dự đoán xơ hóa gan ở bệnh nhân gan nhiễm mỡ không do rượu, cả ở những bệnh nhân béo phì và không béo phì.
Giá trị của FIB-4:
NAFLD Fibrosis Score (NFS)
NFS là một hệ thống điểm khác được sử dụng rộng rãi để dự đoán mức độ xơ hóa của gan trong gan nhiễm mỡ không do rượu. Hệ thống này kết hợp các đặc điểm của bệnh nhân, bao gồm tuổi, chỉ số BMI, mức đường huyết lúc đói, AST, ALT, albumin và số lượng tiểu cầu. Với ngưỡng -1.455, NFS có giá trị dự đoán âm tính khoảng 90%, nghĩa là có thể loại trừ được xơ gan ở bệnh nhân gan nhiễm mỡ không do rượu.
Giá trị của NFS:
Enhanced Liver Fibrosis (ELF)
ELF là một công cụ xét nghiệm máu dựa trên các yếu tố sinh hóa, bao gồm mức độ axit hyaluronic, peptide N-terminal của procollagen III và chất ức chế metalloproteinase mô loại I. ELF được chứng minh có thể phân biệt được mức độ xơ gan nhẹ (F0/F1) và xơ gan nặng (F2/F3).
Giá trị của ELF:
3.2.1.2. Những Hạn Chế Của Các Xét Nghiệm Máu
Mặc dù các xét nghiệm máu này là công cụ không xâm lấn và hiệu quả trong việc phân tầng nguy cơ, nhưng chúng không phải lúc nào cũng chính xác 100%. Ví dụ:
FIB-4 có thể không chính xác đối với những bệnh nhân trên 65 tuổi hoặc những người có bệnh lý thận mạn tính.
Các xét nghiệm như NFS và FIB-4 có thể không hiệu quả với một số nhóm dân cư đặc biệt, chẳng hạn như những người có bệnh lý gan do rượu hoặc bệnh gan tự miễn.
3.2.1.3. Kết Hợp Xét Nghiệm Máu và Các Phương Pháp Khác
Để đánh giá chính xác hơn về mức độ xơ hóa gan và nguy cơ tiến triển của gan nhiễm mỡ không do rượu, các xét nghiệm máu có thể được kết hợp với các phương pháp xét nghiệm không xâm lấn khác như siêu âm gan, elastography (đo độ cứng của gan) và MRI.
Các xét nghiệm này cung cấp một cái nhìn toàn diện hơn về tình trạng gan của bệnh nhân, giúp bác sĩ đưa ra quyết định điều trị phù hợp. Siêu âm và các phương pháp elastography có thể giúp xác định độ cứng của gan, từ đó xác định mức độ xơ gan và nguy cơ bệnh tiến triển.
3.2. Siêu Âm Gan
Siêu âm gan là một trong những phương pháp phổ biến và dễ dàng nhất để chẩn đoán gan nhiễm mỡ. Đây là một phương pháp không xâm lấn, có thể giúp phát hiện sự tích tụ mỡ trong gan. Siêu âm cũng giúp loại trừ các nguyên nhân khác có thể gây ra các triệu chứng tương tự, chẳng hạn như gan nhiễm mỡ do rượu hoặc các bệnh lý gan khác.
Siêu Âm Gan và 2D-SWE: Phương Pháp Tiên Tiến Để Đánh Giá Xơ Gan
Siêu âm gan dựa trên kỹ thuật sóng cắt đôi (2D-SWE) là một phương pháp sử dụng sóng siêu âm để đo độ cứng của gan. Đây là một kỹ thuật không xâm lấn, dễ thực hiện và có thể đo đạc độ cứng của gan tại nhiều khu vực khác nhau, giúp đánh giá tình trạng xơ gan hoặc gan nhiễm mỡ một cách toàn diện và chính xác hơn.
2D-SWE sử dụng sóng siêu âm truyền qua mô gan để đánh giá sự thay đổi của sóng khi chúng gặp phải mô có độ cứng khác nhau. Các mô gan bị xơ hoặc tổn thương sẽ phản xạ lại sóng siêu âm khác biệt so với mô gan bình thường, từ đó cho phép xác định mức độ tổn thương.
Ưu Điểm Của Siêu Âm 2D-SWE
Chẩn Đoán Chính Xác: Các nghiên cứu đã chỉ ra rằng 2D-SWE có độ chính xác cao trong việc phát hiện gan nhiễm mỡ và xơ gan. Các giá trị đo được từ 2D-SWE giúp phân biệt giữa gan bình thường và gan có dấu hiệu tổn thương, với độ nhạy và độ đặc hiệu tương đương với các phương pháp hình ảnh khác như VCTE (vibration-controlled transient elastography) và MRE (magnetic resonance elastography).
Không Xâm Lấn và An Toàn: Siêu âm 2D-SWE là một phương pháp không xâm lấn, không cần dùng đến chất cản quang hay thuốc, do đó rất an toàn cho người bệnh, đặc biệt là những người có tình trạng sức khỏe yếu hoặc mắc các bệnh lý mãn tính.
Tiết Kiệm Thời Gian và Chi Phí: Siêu âm 2D-SWE có thể thực hiện nhanh chóng trong môi trường phòng khám hoặc bệnh viện, với chi phí hợp lý hơn so với các phương pháp hình ảnh khác như MRE. Điều này giúp giảm gánh nặng chi phí cho bệnh nhân và làm cho việc chẩn đoán trở nên dễ dàng và phổ biến hơn.
Đánh Giá Toàn Diện: Bằng cách đo độ cứng của gan ở nhiều vị trí khác nhau, 2D-SWE có thể cung cấp thông tin chính xác và toàn diện hơn về mức độ tổn thương của gan, giúp bác sĩ đưa ra phác đồ điều trị phù hợp.
Siêu Âm 2D-SWE Trong Việc Phát Hiện Gan Nhiễm Mỡ Không Do Rượu
Gan nhiễm mỡ không do rượu (NAFLD) thường không có triệu chứng rõ ràng ở giai đoạn đầu. Chính vì vậy, việc phát hiện sớm thông qua các xét nghiệm hình ảnh như 2D-SWE là rất quan trọng để ngăn ngừa các biến chứng nghiêm trọng như xơ gan và ung thư gan.
Khi bệnh nhân có các yếu tố nguy cơ như thừa cân, tiểu đường, hoặc tăng mỡ máu, bác sĩ có thể sử dụng siêu âm 2D-SWE để kiểm tra độ cứng của gan. Các nghiên cứu cho thấy, với một ngưỡng nhất định của độ cứng gan (thường là trên 7.9 kPa), phương pháp này có thể giúp loại trừ nguy cơ xơ gan ở những bệnh nhân có gan nhiễm mỡ. Ngược lại, nếu kết quả đo được vượt quá ngưỡng này, bệnh nhân có thể cần thêm các xét nghiệm để xác định mức độ tổn thương gan và lên kế hoạch điều trị kịp thời.
Tương Lai Của Siêu Âm 2D-SWE Trong Chẩn Đoán Gan Nhiễm Mỡ
Mặc dù siêu âm 2D-SWE đã được chứng minh là hiệu quả trong việc chẩn đoán gan nhiễm mỡ và xơ gan, nhưng việc áp dụng rộng rãi phương pháp này vẫn còn gặp phải một số thách thức. Một trong những yếu tố quan trọng là sự phát triển của công nghệ và việc đào tạo các bác sĩ để sử dụng thành thạo thiết bị này. Hơn nữa, siêu âm 2D-SWE vẫn cần được kết hợp với các xét nghiệm và phương pháp hình ảnh khác để có được kết quả chính xác hơn, đặc biệt trong những trường hợp không rõ ràng.
Siêu âm 2D-SWE là một công cụ hữu ích và đáng tin cậy trong việc chẩn đoán gan nhiễm mỡ không do rượu. Phương pháp này không chỉ giúp đánh giá chính xác mức độ tổn thương gan mà còn tiết kiệm thời gian, chi phí và an toàn cho người bệnh. Với sự tiến bộ của công nghệ, siêu âm 2D-SWE có tiềm năng trở thành một phương pháp chuẩn mực trong việc theo dõi và điều trị gan nhiễm mỡ, mang lại cơ hội cải thiện chất lượng điều trị cho bệnh nhân.
3.3. Các Phương Pháp Đo Lường Xơ Gan (Fibrosis)
Một trong những yếu tố quan trọng để đánh giá nguy cơ tiến triển của gan nhiễm mỡ không do rượu là mức độ xơ hóa gan. Các chỉ số và công cụ như NAFLD Fibrosis Score (NFS), Fibrosis-4 index (FIB-4), hoặc vibration-controlled transient elastography (VCTE) có thể giúp đánh giá mức độ xơ hóa của gan mà không cần phải thực hiện sinh thiết. Đây là những công cụ đánh giá không xâm lấn giúp phân tầng nguy cơ và đưa ra chiến lược điều trị phù hợp.
3.4. Sinh Thiết Gan
Mặc dù không phải là phương pháp sàng lọc hàng đầu, sinh thiết gan vẫn là tiêu chuẩn vàng trong việc đánh giá mức độ xơ hóa và viêm gan (NASH – viêm gan nhiễm mỡ không do rượu). Sinh thiết có thể giúp xác định chính xác mức độ tổn thương của gan, từ đó đưa ra phương án điều trị thích hợp. Tuy nhiên, phương pháp này đòi hỏi xâm lấn và có thể gây đau đớn cho bệnh nhân, do đó chỉ được sử dụng trong những trường hợp cần thiết hoặc khi các phương pháp khác không đủ rõ ràng.
3.5. Khảo Sát Dựa Trên Các Yếu Tố Nguy Cơ
Với các bệnh nhân có nguy cơ cao, bao gồm người mắc tiểu đường type 2, hội chứng chuyển hóa, hoặc có mức enzyme gan bất thường, việc tiến hành sàng lọc sớm là cực kỳ quan trọng. Hiện tại, hướng dẫn của Hiệp hội Nghiên cứu bệnh gan Mỹ (AASLD) khuyến khích bác sĩ nên cảnh giác cao với khả năng mắc gan nhiễm mỡ không do rượu và viêm gan nhiễm mỡ không do rượu ở những bệnh nhân này. Cùng với đó, việc sử dụng các công cụ như NFS hoặc FIB-4 giúp đánh giá nguy cơ xơ gan ở những bệnh nhân có dấu hiệu nghi ngờ.
3.6. Tầm Quan Trọng Của Việc Sàng Lọc Cho Bệnh Nhân Có Nguy Cơ Cao
Các nghiên cứu gần đây cho thấy việc sàng lọc và điều trị sớm gan nhiễm mỡ không do rượu ở các nhóm bệnh nhân có nguy cơ cao như bệnh nhân tiểu đường type 2 hoặc hội chứng chuyển hóa có thể giúp giảm thiểu chi phí và cải thiện kết quả sức khỏe. Cụ thể, việc sử dụng siêu âm gan kết hợp với xét nghiệm hóa sinh và đánh giá xơ gan là phương pháp chi phí hợp lý và mang lại hiệu quả trong việc phát hiện sớm và điều trị gan nhiễm mỡ không do rượu ở những đối tượng này.
Hiện vẫn chưa có loại thuốc đặc trị duy nhất cho gan nhiễm mỡ giai đoạn sớm (không kèm biến chứng nặng). Thay vào đó, bác sĩ thường tập trung vào việc kiểm soát các bệnh lý nền như đái tháo đường (bằng thuốc hạ đường huyết, ví dụ metformin, nhóm ức chế SGLT2, chất chủ vận GLP-1), tăng huyết áp và rối loạn lipid (bằng các thuốc hạ mỡ máu như statin, fibrate hoặc thuốc hạ áp). Việc điều trị hỗ trợ gan có thể kết hợp sử dụng Vitamin E liều cao, dù cần theo dõi chặt chẽ, Acid Ursodeoxycholic (UDCA) trong một số trường hợp, cũng như các thuốc đang được nghiên cứu như obeticholic acid và pioglitazone. Bên cạnh đó, thay đổi lối sống đóng vai trò quan trọng, bao gồm giảm cân và duy trì cân nặng hợp lý bằng chế độ ăn lành mạnh (hạn chế chất béo, đường tinh luyện, rượu bia) và tăng cường vận động (tối thiểu 30 phút/ngày, 5 ngày/tuần). Cuối cùng, kiểm soát căng thẳng và ngủ đủ giấc cũng hỗ trợ tích cực cho quá trình điều trị và ngăn ngừa tiến triển của bệnh.
4.1. Chế độ carbonhydrate
Gan nhiễm mỡ không do rượu (NAFLD) là một bệnh lý gan phổ biến, chủ yếu liên quan đến thói quen ăn uống và lối sống không lành mạnh. Một trong những yếu tố quan trọng góp phần vào sự phát triển và tiến triển của bệnh là chế độ dinh dưỡng, đặc biệt là carbohydrate (CHO). Việc hiểu rõ tác động của các loại carbohydrate đối với sức khỏe gan sẽ giúp xây dựng các chế độ ăn uống phù hợp để ngăn ngừa và điều trị bệnh này.
Các Loại Carbohydrate và Tác Động Đến Gan
Carbohydrate, thành phần dinh dưỡng chính trong chế độ ăn, có thể được chia thành hai loại cơ bản: carbohydrate đơn giản và carbohydrate phức tạp. Tùy thuộc vào nguồn gốc và cách thức tiêu hóa, các loại carbohydrate này có ảnh hưởng rất khác biệt đối với sự tích tụ mỡ trong gan và sự phát triển của bệnh gan nhiễm mỡ không do rượu.
Carbohydrate Đơn Giản (Simple Carbohydrates)
Carbohydrate đơn giản bao gồm monosaccharides (glucose, fructose) và disaccharides (sucrose, lactose). Những carbohydrate này dễ dàng bị cơ thể hấp thu và chuyển hóa thành glucose nhanh chóng, dẫn đến sự gia tăng đột ngột lượng đường trong máu. Tuy nhiên, chúng lại không cung cấp nhiều chất dinh dưỡng bổ sung ngoài năng lượng, đặc biệt là carbohydrate đơn giản đã qua chế biến như đường tinh luyện, các loại bánh ngọt, nước ngọt và các thực phẩm chế biến sẵn.
Một trong những nguồn carbohydrate đơn giản phổ biến liên quan đến gan nhiễm mỡ không do rượu là fructose (đường fructose). Fructose, đặc biệt là trong siro ngô có hàm lượng fructose cao (HFCS), đã được chứng minh là có mối liên hệ mạnh mẽ với sự phát triển của gan nhiễm mỡ và thậm chí là xơ gan. HFCS được tìm thấy trong nhiều sản phẩm thực phẩm chế biến sẵn như soda, nước ngọt, các món tráng miệng chế biến sẵn, và các loại bánh mì công nghiệp. Khi tiêu thụ quá nhiều fructose, cơ thể dễ dàng chuyển hóa chúng thành mỡ trong gan (de novo lipogenesis), góp phần vào sự tích tụ mỡ và viêm gan.
Carbohydrate Phức Tạp (Complex Carbohydrates)
Carbohydrate phức tạp, bao gồm các ngũ cốc nguyên hạt, hạt đậu, các loại rau củ, và các loại tinh bột chưa qua chế biến. Chúng được tiêu hóa chậm hơn so với carbohydrate đơn giản, cung cấp năng lượng bền vững và giúp cảm giác no lâu hơn. Những loại carbohydrate này có lợi cho sức khỏe gan, vì chúng chứa nhiều chất xơ và các vitamin, khoáng chất cần thiết cho cơ thể, đồng thời không làm tăng đột ngột lượng đường trong máu.
Carbohydrate phức tạp không chỉ giúp duy trì mức glucose ổn định mà còn hỗ trợ giảm mỡ nội tạng, điều này rất quan trọng trong việc kiểm soát bệnh gan nhiễm mỡ không do rượu. Tuy nhiên, carbohydrate phức tạp đã qua chế biến như bánh mì trắng hay gạo trắng có giá trị dinh dưỡng thấp hơn và cũng có thể gây tăng mỡ trong gan nếu tiêu thụ quá nhiều.
Chế Độ Dinh Dưỡng Carbonhydrate và Gan Nhiễm Mỡ Không Do Rượu
Ảnh Hưởng Của Carbohydrate Đến Gan
Việc tiêu thụ quá nhiều carbohydrate, đặc biệt là các loại carbohydrate có chỉ số glycemic cao (GI), có thể dẫn đến tăng mỡ gan và viêm gan, hai yếu tố quan trọng trong sự phát triển của gan nhiễm mỡ không do rượu. Các nghiên cứu đã chỉ ra rằng, carbohydrate đơn giản, đặc biệt là sucrose và fructose, thúc đẩy quá trình tích tụ mỡ trong gan và tăng nồng độ triglyceride trong máu ngay cả khi không có sự gia tăng cân nặng toàn cơ thể. Điều này có nghĩa là những người tiêu thụ nhiều nước ngọt có đường và thực phẩm chế biến sẵn có nguy cơ cao mắc phải gan nhiễm mỡ không do rượu, dù họ có thể không bị thừa cân.
Một nghiên cứu đã chỉ ra rằng việc tiêu thụ hơn 7 ly đồ uống có đường mỗi tuần có liên quan đến gia tăng mức độ viêm và xơ hóa gan ở những người mắc gan nhiễm mỡ không do rượu, khi kiểm soát yếu tố tuổi tác, chỉ số khối cơ thể (BMI) và lượng calo tổng thể.
Chế Độ Dinh Dưỡng Low-Carb và gan nhiễm mỡ không do rượu
Các chế độ ăn low-carb (ít carbohydrate) đã được nghiên cứu và áp dụng trong điều trị gan nhiễm mỡ không do rượu. Chế độ ăn này chủ yếu bao gồm protein và chất béo lành mạnh, với lượng carbohydrate được giới hạn ở mức thấp (40–60g/ngày). Một số nghiên cứu cho thấy rằng chế độ ăn low-carb có thể giúp giảm mỡ gan hiệu quả hơn so với các chế độ ăn ít chất béo. Cụ thể, một nghiên cứu đã so sánh chế độ ăn low-carb (25% calo từ CHO) với chế độ ăn ít chất béo (60–70% calo từ CHO) và cho thấy rằng chế độ ăn low-carb có hiệu quả hơn trong việc giảm lượng mỡ trong gan.
Ngoài ra, chế độ Ketogenic (chế độ ăn rất ít carbohydrate, chỉ dưới 20g/ngày) cũng đã được chứng minh là có tác dụng cải thiện tình trạng gan nhiễm mỡ không do rượu ở một số bệnh nhân, mặc dù chế độ này có thể gây khó khăn trong việc duy trì lâu dài do hạn chế rất nghiêm ngặt về carbohydrate.
4.2. Chế độ chất béo
Một trong những yếu tố dinh dưỡng quan trọng ảnh hưởng đến sự phát triển và tiến triển của gan nhiễm mỡ không do rượu chính là chất béo trong chế độ ăn uống. Đặc biệt, tác động của các loại chất béo khác nhau đối với gan nhiễm mỡ có thể rất khác nhau và cần được chú ý trong việc xây dựng chế độ ăn hợp lý.
4.2.1. Chất Béo Chuyển Hóa (Trans Fatty Acids – TFA)
Trans-fatty acids (TFA), hay còn gọi là acid béo chuyển hóa, là những chất béo không có giá trị dinh dưỡng và cần phải loại bỏ khỏi chế độ ăn uống. TFA thường có mặt trong các thực phẩm chế biến sẵn như thức ăn nhanh, đồ chiên rán, bánh ngọt, và các sản phẩm làm từ dầu thực vật hydro hóa để kéo dài thời gian bảo quản và duy trì độ bền vững của thực phẩm. Các nghiên cứu đã chỉ ra rằng TFA có thể thúc đẩy tình trạng viêm nhiễm trong cơ thể, làm tăng nguy cơ mắc các bệnh tim mạch và tăng cân, đồng thời góp phần vào sự phát triển của gan nhiễm mỡ. Vì lý do này, Cục Quản lý Thực phẩm và Dược phẩm Mỹ (FDA) đã yêu cầu loại bỏ TFA khỏi thực phẩm.
4.2.2. Chất Béo Bão Hòa (Saturated Fatty Acids – SFA)
Chất béo bão hòa (SFA) chủ yếu đến từ các nguồn động vật và có mặt trong các sản phẩm như bơ, phô mai béo, thịt đỏ, các sản phẩm từ sữa nguyên kem và dầu dừa, dầu cọ. Mặc dù SFA không cung cấp giá trị dinh dưỡng bổ sung cho cơ thể, nhưng lại có mối liên hệ chặt chẽ với nguy cơ mắc bệnh tim mạch và béo phì. Các nghiên cứu đã chỉ ra rằng chế độ ăn giàu SFA có thể làm tăng tình trạng mỡ trong gan (hepatic steatosis) và gây viêm gan, đặc biệt là trong các bệnh nhân bị gan nhiễm mỡ không do rượu. Do đó, các chuyên gia dinh dưỡng khuyến cáo nên hạn chế SFA dưới 7% tổng lượng calo hàng ngày.
4.2.3. Chất Béo Không Bão Hòa (Unsaturated Fatty Acids – UFA)
Chất béo không bão hòa (UFA) chủ yếu đến từ các nguồn thực vật như dầu thực vật, hạt, và quả bơ, và được coi là nhóm chất béo có giá trị dinh dưỡng cao. Các nghiên cứu đã chỉ ra rằng UFA, đặc biệt là omega-3 và omega-6, có thể mang lại những lợi ích đáng kể cho sức khỏe gan. Omega-3, một loại polyunsaturated fatty acid (PUFA), được chứng minh là có tác dụng chống viêm và cải thiện độ nhạy insulin, giúp giảm sự phát triển của hepatic steatosis (mỡ trong gan). Ngoài ra, chế độ ăn giàu omega-3 còn có tác dụng giảm mỡ visceral (mỡ trong bụng) và cải thiện chức năng gan. Một số nghiên cứu cho thấy, người mắc bệnh viêm gan không do rượu (NASH) có xu hướng tiêu thụ nhiều SFA và cholesterol, nhưng lại ít tiêu thụ PUFA, dẫn đến gia tăng tình trạng gan nhiễm mỡ và viêm gan.
4.2.4. Chế Độ Ăn Giàu Omega-3 vs. Omega-6
Mặc dù cả omega-3 và omega-6 đều thuộc nhóm PUFA, các nghiên cứu cho thấy omega-3 có tác dụng bảo vệ gan tốt hơn omega-6. Một nghiên cứu với 39 người có cân nặng bình thường cho thấy, khi tiêu thụ SFA, các bệnh nhân bị gan nhiễm mỡ không do rượu có sự gia tăng đáng kể mỡ trong gan và mỡ visceral so với nhóm sử dụng omega-6. Điều này cho thấy rằng omega-3 có thể giúp làm giảm sự phát triển của hepatic steatosis so với các chất béo khác. Omega-3 có thể được tìm thấy trong các loại cá béo như cá hồi, cá thu, hạt chia, và hạt lanh.
4.2.5. Lợi Ích của Omega-3 trong Điều Trị gan nhiễm mỡ không do rượu
Omega-3 có thể giúp cải thiện tình trạng của gan, giảm mỡ trong gan và giảm viêm. Một số nghiên cứu đã chỉ ra rằng việc bổ sung omega-3, thông qua thực phẩm hoặc viên uống bổ sung, có thể làm giảm sự tích tụ mỡ trong gan, thậm chí làm giảm mức độ viêm trong gan của bệnh nhân gan nhiễm mỡ không do rượu. Tuy nhiên, vẫn có sự không nhất quán trong kết quả giữa các nghiên cứu về hiệu quả của việc bổ sung omega-3, do sự khác biệt trong thiết kế nghiên cứu và phương pháp điều trị.
4.2.6. Tỷ Lệ Chất Béo Trong Chế Độ Ăn
Tỷ lệ chất béo trong chế độ ăn uống có thể ảnh hưởng đến sự phát triển của gan nhiễm mỡ không do rượu. Theo các khuyến cáo, tổng lượng chất béo nên chiếm từ 20% đến 35% tổng năng lượng trong chế độ ăn hàng ngày. Các chế độ ăn ít chất béo (LF) thường cung cấp ít hơn 30% năng lượng từ chất béo, trong khi chế độ ăn của người Mỹ trung bình có khoảng 35–40% năng lượng từ chất béo. Việc lựa chọn các nguồn chất béo lành mạnh, như UFA từ thực vật, và hạn chế tiêu thụ các chất béo bão hòa và chuyển hóa, có thể giúp kiểm soát tình trạng gan nhiễm mỡ không do rượu.
4.3. Chế độ protein
Các yếu tố như chế độ ăn uống, hoạt động thể chất và các thói quen sống là những yếu tố quan trọng ảnh hưởng đến sự phát triển và tiến triển của bệnh. Trong đó, chế độ dinh dưỡng, đặc biệt là lượng protein và calo trong khẩu phần ăn, đóng vai trò then chốt trong việc quản lý và điều trị gan nhiễm mỡ không do rượu.
4.3.1. Chế Độ Dinh Dưỡng Protein trong Gan Nhiễm Mỡ
Chế độ dinh dưỡng protein có thể ảnh hưởng đáng kể đến sự tiến triển của gan nhiễm mỡ. Lượng protein cần thiết cho cơ thể được tính toán dựa trên nhu cầu dinh dưỡng hàng ngày (RDA), và thường được khuyến cáo là 0.8 g/kg trọng lượng cơ thể mỗi ngày đối với protein chất lượng cao, với ưu tiên cho nguồn protein thực vật. Mặc dù không có nhiều nghiên cứu tập trung vào tác động của lượng protein và nguồn protein khác nhau trong việc điều trị gan nhiễm mỡ không do rượu, một số nghiên cứu đã cho thấy những kết quả khả quan.
Một nghiên cứu với 48 bệnh nhân mắc gan nhiễm mỡ không do rượu đã áp dụng chế độ ăn ít calo nhưng giàu protein (1,299 kcal/ngày đối với phụ nữ và 1,400 kcal/ngày đối với nam giới, với 25% chất béo, 35% protein và 40% carbohydrate) trong 75 ngày, kết quả cho thấy sự cải thiện đáng kể về hồ sơ lipid và các chỉ số men gan. Tuy nhiên, nghiên cứu này chỉ ra rằng nguồn protein chứ không phải tỷ lệ phần trăm protein trong chế độ ăn mới là yếu tố quan trọng ảnh hưởng đến kết quả gan.
Nguồn Protein Nào Tốt Cho Gan?
Các nguồn protein động vật như thịt đỏ và các sản phẩm chế biến sẵn có xu hướng chứa nhiều chất béo bão hòa (SFA) và cholesterol, những yếu tố có thể làm tăng nguy cơ mắc bệnh tiểu đường và bệnh tim mạch. Hơn nữa, các phương pháp chế biến như nướng hoặc chiên có thể tạo ra các hợp chất hóa học độc hại như amin dị vòng (HCA), có liên quan đến ung thư và gia tăng stress oxy hóa.
Ngược lại, protein từ thực vật, các sản phẩm từ sữa ít béo, gia cầm, cá và các loại hạt đã được chứng minh có mối liên hệ thuận lợi với việc giảm cân, giảm nguy cơ tim mạch, cũng như giảm men gan và mỡ trong gan. Các nghiên cứu cho thấy chế độ ăn chủ yếu từ các nguồn protein này có thể giúp giảm tình trạng mỡ trong gan (hepatic steatosis), giảm viêm và cải thiện chức năng gan.
4.3.2. Tổng Lượng Calo và Kiểm Soát Calo trong Gan Nhiễm Mỡ
Lượng calo dư thừa là một trong những nguyên nhân chính dẫn đến béo phì và các bệnh chuyển hóa, bao gồm gan nhiễm mỡ không do rượu. Việc kiểm soát lượng calo trong chế độ ăn không chỉ giúp giảm cân mà còn đóng vai trò quan trọng trong việc giảm mỡ trong gan.
Các hướng dẫn từ Hiệp hội Nghiên cứu Gan Hoa Kỳ (AASLD) và Hiệp hội Nghiên cứu Gan Châu Âu (EASL) khuyến cáo sử dụng chế độ ăn giảm calo, đặc biệt là giảm 500–1,000 kcal mỗi ngày như một phần của can thiệp thay đổi lối sống cho bệnh nhân NAFLD/NASH. Các nghiên cứu đã chứng minh rằng việc giảm lượng calo có thể thúc đẩy việc di chuyển mỡ gan ra khỏi cơ thể, giảm thiểu tình trạng gan nhiễm mỡ và cải thiện các chỉ số chức năng gan.
Tác Dụng Của Giảm Calo
Việc giảm lượng calo hàng ngày ít nhất 30%, tương đương với khoảng 750–1,000 kcal/ngày, đã được chứng minh có thể giảm mỡ trong gan. Các nghiên cứu cho thấy ngay cả khi giảm calo ít hơn (chỉ 500 kcal/ngày trong 6 tuần), cũng có thể ghi nhận sự giảm mỡ trong gan qua siêu âm. Một nghiên cứu trên 261 bệnh nhân mắc viêm gan nhiễm mỡ không do rượu đã áp dụng chế độ ăn giảm 750 kcal/ngày và theo dõi trong 1 năm cho thấy có mối quan hệ rõ ràng giữa việc giảm cân và cải thiện kết quả xét nghiệm sinh thiết gan.
Chế Độ Ăn Giảm Calo Mức Rất Thấp
Một nghiên cứu khác với 34 bệnh nhân thực hiện chế độ ăn giảm calo rất thấp (550 kcal/ngày với 50% carbohydrate, 7% chất béo và 43% protein) trong 7 tuần đã ghi nhận sự giảm 11% trọng lượng cơ thể và giảm 60% triglyceride nội tạng trong gan. Mặc dù những chế độ ăn này có thể giúp giảm mỡ trong gan, nhưng cần có sự giám sát chặt chẽ của các chuyên gia dinh dưỡng để đảm bảo rằng bệnh nhân không bị thiếu hụt dinh dưỡng trong quá trình giảm calo.
4.4. Chế độ ăn địa trung hải
4.4.1. Chế Độ Ăn Địa Trung Hải (Mediterranean Diet)
Chế độ ăn Địa Trung Hải (MD) là một trong những chế độ ăn uống phổ biến và được nghiên cứu nhiều nhất đối với bệnh gan nhiễm mỡ không do rượu. Chế độ ăn này đặc trưng bởi sự tập trung vào thực phẩm có nguồn gốc thực vật, các chất béo không bão hòa như dầu ô liu, và hạn chế tối đa các thực phẩm chứa chất béo bão hòa, thịt đỏ và các sản phẩm từ sữa. Ngoài ra, chế độ ăn này cũng bao gồm protein từ cá, hải sản và gia cầm, và đặc biệt, hạn chế lượng carbohydrate, đặc biệt là các loại đường tinh chế.
Chế độ ăn Địa Trung Hải cung cấp khoảng 40% calo từ chất béo, chủ yếu là chất béo không bão hòa và omega-3. Mặc dù có sự khuyến cáo sử dụng rượu vang như một phần của chế độ ăn này, tuy nhiên, đối với bệnh nhân có bệnh gan, đặc biệt là những người mắc xơ gan, việc tiêu thụ rượu cần phải được giám sát chặt chẽ hoặc hoàn toàn kiêng cữ.
Lợi Ích Của Chế Độ Ăn Địa Trung Hải
Nghiên cứu đã chỉ ra rằng chế độ ăn Địa Trung Hải không chỉ có lợi cho sức khỏe tim mạch mà còn giúp giảm mỡ trong gan, cải thiện các chỉ số men gan và giảm tình trạng viêm gan. Một nghiên cứu ngẫu nhiên (RCT) với 98 bệnh nhân mắc gan nhiễm mỡ không do rượu, áp dụng chế độ ăn Địa Trung Hải trong 6 tháng, đã ghi nhận sự cải thiện đáng kể về tình trạng gan qua siêu âm, với giảm mỡ trong gan và cải thiện chỉ số viêm gan nhiễm mỡ không do rượu.
Chế độ ăn Địa Trung Hải còn giúp cải thiện độ cứng của gan, một chỉ số quan trọng trong việc đánh giá mức độ tổn thương gan thông qua phương pháp đo độ đàn hồi sóng cắt (shear-wave elastography). Thêm vào đó, chế độ ăn này còn có tác dụng trong việc giảm tình trạng kháng insulin và giảm mỡ nội tạng.
4.4.2. So Sánh Với Các Chế Độ Ăn Khác
Chế độ ăn Địa Trung Hải có sự khác biệt rõ rệt so với các chế độ ăn khác như chế độ ăn Paleo, trong đó có sự phân biệt về tỷ lệ chất béo và carbohydrate. Chế độ ăn Paleo có tỷ lệ chất béo thấp hơn (35%) và carbohydrate cao hơn (45–65%), trong khi chế độ ăn Địa Trung Hải chỉ cung cấp khoảng 40% calo từ chất béo và giảm lượng carbohydrate xuống 40%. Mặc dù có sự khác biệt này, nhưng cả hai chế độ ăn đều nhấn mạnh việc hạn chế tinh bột tinh chế và đường.
Một nghiên cứu so sánh chế độ ăn Địa Trung Hải với chế độ ăn ít carbohydrate (low-carb, LF) và chế độ ăn ít chất béo (low-fat, LF) đã chỉ ra rằng cả hai chế độ ăn Địa Trung Hải và LF đều giúp giảm mỡ trong gan, nhưng việc tuân thủ chế độ ăn Địa Trung Hải có tỉ lệ cao hơn so với chế độ ăn ít chất béo.
4.4.3. Chế Độ Ăn FLiO – Fatty Liver in Obesity Diet
Một biến thể của chế độ ăn Địa Trung Hải, được gọi là chế độ ăn FLiO (Fatty Liver in Obesity), đã được phát triển để điều trị bệnh gan nhiễm mỡ ở những bệnh nhân thừa cân hoặc béo phì. Chế độ ăn này bao gồm 7 bữa ăn mỗi ngày, với 40–45% carbohydrate từ thực phẩm có chỉ số đường huyết thấp (low-GI), 25% protein chủ yếu từ thực vật và 30–35% chất béo tổng thể.
Kết quả từ một nghiên cứu kéo dài 26 tuần trên 98 bệnh nhân gan nhiễm mỡ không do rượu cho thấy chế độ ăn FLiO giúp giảm mỡ gan, giảm triglyceride và giảm tình trạng steatosis (mỡ trong gan). Dù không có sự khác biệt đáng kể giữa chế độ ăn FLiO và chế độ ăn AHA (Hiệp hội Tim mạch Hoa Kỳ), nhưng cả hai chế độ ăn đều giúp giảm cân và cải thiện các chỉ số sinh hóa liên quan đến mỡ trong gan.
4.4.4. Chế Độ Ăn Cho Người Mắc Gan Nhiễm Mỡ Không Do Rượu
Chế độ ăn cho người mắc gan nhiễm mỡ không do rượu cần được thiết kế sao cho cung cấp đủ dinh dưỡng và hỗ trợ giảm mỡ gan. Dưới đây là những nguyên tắc cơ bản của một chế độ ăn hợp lý:
Giảm lượng calo tổng thể: Việc giảm calo là rất quan trọng để giảm mỡ trong gan. Chế độ ăn giảm 500–1,000 kcal/ngày có thể giúp giảm mỡ trong gan và cải thiện các chỉ số chức năng gan.
Tăng cường chất béo không bão hòa: Hãy tập trung vào các nguồn chất béo lành mạnh từ dầu ô liu, các loại hạt, cá và hải sản giàu omega-3.
Hạn chế chất béo bão hòa và carbohydrate tinh chế: Giảm tiêu thụ thịt đỏ, các sản phẩm từ sữa chứa chất béo cao và các thực phẩm chứa đường tinh chế để giảm tình trạng viêm và cải thiện sức khỏe gan.
Tăng cường thực phẩm từ thực vật: Các loại rau, quả, hạt, và ngũ cốc nguyên hạt là nguồn cung cấp chất xơ và các chất dinh dưỡng quan trọng cho gan.
4.5. Các chế độ ăn khác
Gan nhiễm mỡ không do rượu (NAFLD) là một tình trạng sức khỏe ngày càng phổ biến, đòi hỏi sự quan tâm đặc biệt đến chế độ ăn uống. Dưới đây là phân tích chi tiết về các chế độ ăn có liên quan đến gan nhiễm mỡ không do rượu.
4.5.1. Chế độ ăn DASH
Chế độ ăn DASH (Dietary Approaches to Stop Hypertension) đã được nghiên cứu và cho thấy có mối liên hệ nghịch đảo với nguy cơ mắc gan nhiễm mỡ không do rượu. Một nghiên cứu cắt ngang trên 11,888 người tham gia đã chỉ ra rằng việc tuân thủ chế độ DASH giúp giảm nguy cơ mắc gan nhiễm mỡ không do rượu. Một nghiên cứu khác của Razavi và cộng sự đã so sánh chế độ DASH với chế độ ăn hạn chế calo (52–55% carbohydrate, 16–18% protein, và 30% chất béo). Kết quả cho thấy nhóm ăn theo chế độ DASH giảm trung bình 3,8 ± 2,2 kg, cao hơn so với nhóm ăn hạn chế calo (2,3 ± 1,7 kg). Đồng thời, nhóm này cũng cải thiện đáng kể các chỉ số men gan ALT và triglyceride.
4.5.2. Chế độ nhịn ăn gián đoạn (Intermittent Fasting – IF)
Nhịn ăn gián đoạn cũng đã được xem xét như một phương pháp tiềm năng điều trị gan nhiễm mỡ không do rượu. Dưới đây là một số hình thức và kết quả nghiên cứu liên quan:
Chế độ MADCR (Modified Alternate Day Calorie Restriction): Trong nghiên cứu của Johari và cộng sự, 43 bệnh nhân gan nhiễm mỡ không do rượu tuân theo chế độ hạn chế 70% calo vào các ngày nhịn ăn (ăn trong khung giờ 2–8 giờ tối) xen kẽ với các ngày ăn tự do. Sau 8 tuần, nhóm này giảm trung bình 3,06 kg và có sự cải thiện rõ rệt về mức độ gan nhiễm mỡ và xơ hóa.
Nhịn ăn luân phiên (ADF) và ăn giới hạn thời gian (TRF): Một nghiên cứu khác trên 271 bệnh nhân gan nhiễm mỡ không do rượu so sánh nhịn ăn luân phiên (ADF) và ăn giới hạn trong 8 giờ (TRF) với chế độ ăn giảm calo thông thường (80% nhu cầu năng lượng). Mặc dù không có sự cải thiện đáng kể giữa các nhóm, nhưng trong mỗi nhóm, cân nặng và khối lượng mỡ giảm sau 12 tuần.
Ngoài ra, thời gian tiêu thụ calo cũng ảnh hưởng đến mỡ gan. Một nghiên cứu trên 46 người cho thấy việc tăng tần suất bữa ăn (ăn vặt thường xuyên) làm tăng đáng kể mỡ gan so với việc tăng kích thước bữa ăn.
4.5.3. Mối liên hệ giữa cà phê và gan nhiễm mỡ
Tiêu thụ cà phê được ghi nhận có tác dụng bảo vệ gan, đặc biệt giảm xơ gan. Mối quan hệ giữa cà phê và gan nhiễm mỡ còn mâu thuẫn, nhưng nhiều nghiên cứu đã chỉ ra rằng cả cà phê có caffeine và không caffeine đều có lợi. Tuy nhiên, hiệu quả này chủ yếu được quan sát với cà phê đen, không thêm đường hay sữa.
4.5.4. Chế độ ăn cho người bị xơ gan do viêm gan nhiễm mỡ không do rượu
Đối với bệnh nhân xơ gan do viêm gan nhiễm mỡ không do rượu, chế độ ăn uống cần được điều chỉnh đặc biệt:
Protein: Lượng protein từ 1,0–1,5 g/kg được khuyến nghị để hạn chế mất cơ. Một bữa ăn nhẹ giàu protein trước khi ngủ cũng giúp giảm quá trình phân giải cơ trong lúc nhịn ăn ban đêm.
Natri và nước: Đối với bệnh nhân có cổ trướng hoặc hạ natri máu, lượng muối nên hạn chế ở mức 2g/ngày và nước khoảng 1,5L/ngày nếu nồng độ natri trong huyết thanh ≤125 mmol/L.
Các chế độ ăn như DASH, nhịn ăn gián đoạn, và thời gian tiêu thụ calo có tác động đáng kể đến tình trạng gan nhiễm mỡ. Đồng thời, cà phê và việc quản lý dinh dưỡng phù hợp với từng giai đoạn bệnh cũng đóng vai trò quan trọng. Điều này nhấn mạnh tầm quan trọng của việc thiết kế chế độ ăn phù hợp cho bệnh nhân gan nhiễm mỡ không do rượu để cải thiện sức khỏe và giảm thiểu các biến chứng.
5.1. Cơ chế bệnh sinh của đái tháo đường type 2 và gan nhiễm mỡ (NAFLD)
Đái tháo đường type 2 và gan nhiễm mỡ không do rượu (NAFLD) có mối liên hệ mật thiết với nhau, và cơ chế bệnh sinh của hai tình trạng này chia sẻ nhiều yếu tố chung. Mặc dù cơ chế chính xác vẫn đang được nghiên cứu, các yếu tố cơ bản gây ra cả hai tình trạng này đã được làm rõ.
5.1.1. Kháng insulin và rối loạn chuyển hóa lipid
Kháng insulin là yếu tố quan trọng trong cả đái tháo đường type 2 và gan nhiễm mỡ không do rượu. Khi cơ thể giảm khả năng đáp ứng với insulin, quá trình chuyển hóa lipid bị gián đoạn, dẫn đến tăng tích tụ mỡ trong gan (gan nhiễm mỡ) và gia tăng lượng mỡ trong cơ thể (mỡ nội tạng). Kháng insulin thúc đẩy sự hình thành mỡ mới từ glucose (lipogenesis) trong gan, làm tăng số lượng axit béo tự do đến tế bào gan và gây ra rối loạn lipid máu có tính chất gây xơ vữa động mạch.
5.1.2. Tác động của viêm và stress oxy hóa
Kháng insulin còn bị thúc đẩy bởi viêm toàn thân, stress oxy hóa, rối loạn chức năng ty thể và rối loạn chức năng nội mạc mạch máu. Những yếu tố này góp phần vào việc làm suy giảm khả năng dung nạp glucose (tolerance) và gây ra các vấn đề như glucotoxicity (độc tính của glucose) và lipotoxicity (độc tính của mỡ). Các yếu tố này kết hợp lại, làm tăng nguy cơ tiến triển thành các biến chứng nghiêm trọng hơn, như bệnh tim mạch và xơ gan.
5.1.3. Quá trình tiến triển của gan nhiễm mỡ không do rượu và đái tháo đường type 2
Bệnh gan nhiễm mỡ không do rượu và đái tháo đường type 2 có mối quan hệ qua lại: gan nhiễm mỡ không do rượu có thể làm tăng nguy cơ mắc đái tháo đường type 2, và ngược lại, đái tháo đường type 2 thúc đẩy sự tiến triển của NAFLD thành viêm gan nhiễm mỡ (NASH), xơ gan, và thậm chí ung thư gan (HCC). Trong khi T2D là yếu tố nguy cơ chính làm tăng độ nặng của gan nhiễm mỡ, đặc biệt là trong giai đoạn viêm gan nhiễm mỡ không do rượu và xơ gan, NAFLD lại làm gia tăng nguy cơ mắc T2D, khó kiểm soát hơn.
5.1.4. Ảnh hưởng đến nguy cơ bệnh tim mạch
Sự hiện diện của gan nhiễm mỡ không do rượu trong bệnh nhân đái tháo đường type 2 làm tăng nguy cơ bệnh tim mạch. Các yếu tố gây ra nguy cơ này bao gồm rối loạn lipid máu có tính chất gây xơ vữa động mạch, tăng huyết áp, và sự gia tăng các yếu tố viêm, đông máu, cũng như các chất gây xơ vữa động mạch.
5.1.5. Tỷ lệ mắc và tiến triển của gan nhiễm mỡ không do rượu ở bệnh nhân đái tháo đường type 2
Dựa trên các nghiên cứu, tỷ lệ mắc gan nhiễm mỡ không do rượu ở bệnh nhân đái tháo đường type 2 dao động từ 20% đến 80%, tùy thuộc vào phương pháp chẩn đoán. Những phương pháp thông thường như siêu âm gan hoặc xét nghiệm men gan không đủ nhạy để phát hiện chính xác mức độ gan nhiễm mỡ, khiến tỷ lệ mắc bệnh bị đánh giá thấp. Đặc biệt, 50-90% bệnh nhân mắc gan nhiễm mỡ không do rượu và đái tháo đường type 2 có men gan bình thường.
Người mắc NASH (viêm gan nhiễm mỡ không do rượu) có nguy cơ phát triển đái tháo đường type 2 cao hơn, và nguy cơ này càng gia tăng khi có sự hiện diện của xơ gan nặng. Đái tháo đường type 2 không chỉ tăng nguy cơ tiến triển xơ gan mà còn làm giảm khả năng kiểm soát đường huyết, gây khó khăn trong điều trị.
5.1.6. Nguy cơ xơ gan và ung thư gan (HCC)
Bệnh nhân đái tháo đường type 2 có nguy cơ xơ gan cao gấp đôi so với người bình thường. Khi có thêm các yếu tố nguy cơ như thừa cân béo phì, tăng huyết áp và rối loạn lipid máu, nguy cơ mắc các bệnh gan nghiêm trọng như xơ gan và ung thư gan càng gia tăng. Đặc biệt, khoảng 15% bệnh nhân mắc viêm gan nhiễm mỡ không do rượu sẽ tiến triển thành xơ gan, làm tăng nguy cơ biến chứng bệnh gan giai đoạn cuối và HCC.
5.1.7. Chẩn đoán và tầm quan trọng của phát hiện sớm
Mặc dù tỷ lệ mắc gan nhiễm mỡ không do rượu rất cao ở bệnh nhân đái tháo đường type 2, phần lớn bệnh nhân không nhận thức được bệnh gan của mình. Hơn 70% bệnh nhân đái tháo đường type 2 có thể có gan nhiễm mỡ mà không có dấu hiệu men gan cao, vì vậy việc phát hiện và chẩn đoán sớm rất quan trọng để giảm nguy cơ tiến triển thành xơ gan và ung thư gan. Những biện pháp can thiệp sớm nhằm cải thiện chức năng gan có thể làm giảm nguy cơ phát triển đái tháo đường type 2.
5.2. Bệnh Gan Do Rượu và Các Yếu Tố Nguy Cơ, Biến Chứng của Đái Tháo Đường Type 2 (T2D)
Bệnh gan do rượu (ALD) và đái tháo đường type 2 đều là những tình trạng mãn tính có ảnh hưởng lớn đến sức khỏe của người bệnh. Mặc dù mỗi bệnh có cơ chế bệnh sinh riêng biệt, nhưng sự kết hợp giữa hai bệnh lý này có thể làm gia tăng đáng kể nguy cơ mắc các biến chứng nghiêm trọng, đặc biệt là tổn thương gan và bệnh tim mạch.
5.2.1. Mối Quan Hệ Giữa Bệnh Gan Do Rượu và Đái Tháo Đường Type 2
Cả ALD và đái tháo đường type 2 đều có sự tham gia của yếu tố kháng insulin, viêm mãn tính và rối loạn chuyển hóa, tạo điều kiện thuận lợi cho sự phát triển và tiến triển của bệnh. Khi bệnh nhân bị đái tháo đường type 2, khả năng chuyển hóa glucose của cơ thể bị suy giảm, dẫn đến tăng đường huyết lâu dài. Điều này có thể làm tăng tích tụ mỡ trong gan, từ đó dẫn đến gan nhiễm mỡ không do rượu (NAFLD) và có thể tiến triển thành viêm gan nhiễm mỡ (NASH), xơ gan, và ung thư gan (HCC).
Bệnh gan do rượu (ALD) và gan nhiễm mỡ không do rượu có những yếu tố nguy cơ chung, bao gồm:
Kháng insulin: Đây là yếu tố quan trọng dẫn đến sự tích tụ mỡ trong gan, không chỉ từ chế độ ăn uống mà còn do rối loạn chuyển hóa glucose và lipid.
Viêm mạn tính: Viêm xảy ra trong cả ALD và gan nhiễm mỡ không do rượu, góp phần làm tăng sự xơ hóa gan và nguy cơ tiến triển thành xơ gan hoặc ung thư gan.
Rối loạn chuyển hóa: Mỡ trong gan, đặc biệt là mỡ nội tạng, có thể làm gia tăng nguy cơ mắc bệnh tim mạch, một trong những biến chứng phổ biến ở bệnh nhân đái tháo đường type 2.
5.2.2. Các Yếu Tố Nguy Cơ Của Đái Tháo Đường Type 2 (T2D) Đối Với Bệnh Gan
Đái tháo đường type 2 là một yếu tố nguy cơ quan trọng làm tăng tỷ lệ mắc bệnh gan, đặc biệt là gan nhiễm mỡ không do rượu và viêm gan nhiễm mỡ không do rượu. Bệnh nhân đái tháo đường type 2 có nguy cơ mắc bệnh gan do rượu cao gấp đôi so với những người không mắc bệnh. Các yếu tố nguy cơ chính của đái tháo đường type 2 đối với gan bao gồm:
Kháng insulin: Là nguyên nhân chính làm tăng tích tụ mỡ trong gan. Kháng insulin cũng làm giảm khả năng gan sử dụng mỡ một cách hiệu quả, dẫn đến gan nhiễm mỡ.
Tăng mỡ nội tạng (visceral fat): Mỡ nội tạng là một yếu tố nguy cơ quan trọng gây tổn thương gan và làm tăng nguy cơ viêm gan nhiễm mỡ (NASH).
Viêm và stress oxy hóa: Tình trạng viêm mãn tính do kháng insulin và mỡ thừa có thể làm tăng nguy cơ tổn thương gan và thúc đẩy quá trình xơ hóa, dẫn đến xơ gan và ung thư gan.
Rối loạn lipid máu: đái tháo đường type 2 làm tăng nguy cơ rối loạn lipid máu, đặc biệt là mức độ của cholesterol xấu (LDL) và triglyceride, góp phần vào sự phát triển của xơ vữa động mạch và làm tăng nguy cơ các bệnh tim mạch.
5.2.3. Biến Chứng Của đái tháo đường type 2 Liên Quan Đến Gan
Bệnh nhân đái tháo đường type 2 có thể gặp phải nhiều biến chứng gan nghiêm trọng, bao gồm:
Gan nhiễm mỡ không do rượu (NAFLD): Đây là biến chứng gan phổ biến nhất ở bệnh nhân đái tháo đường type 2. Tình trạng này có thể tiến triển thành viêm gan nhiễm mỡ (NASH) nếu không được điều trị kịp thời.
Viêm gan nhiễm mỡ không do rượu (NASH): viêm gan nhiễm mỡ không do rượu là giai đoạn nặng của gan nhiễm mỡ không do rượu, khi gan không chỉ chứa mỡ mà còn có sự hiện diện của viêm và tổn thương mô gan. Viêm gan nhiễm mỡ không do rượu có thể tiến triển thành xơ gan và làm tăng nguy cơ ung thư gan.
Xơ gan: Xơ gan là tình trạng gan bị tổn thương vĩnh viễn, dẫn đến sự hình thành mô sẹo thay thế cho mô gan bình thường. Ở bệnh nhân đái tháo đường type 2, xơ gan tiến triển nhanh hơn và có thể dẫn đến suy gan hoặc ung thư gan.
Ung thư gan (HCC): Những người mắc đái tháo đường type 2 có nguy cơ mắc ung thư gan cao gấp đôi so với người không mắc bệnh. Mối quan hệ này càng rõ rệt ở những bệnh nhân có viêm gan nhiễm mỡ không do rượu và xơ gan.
5.2.4. Các Can Thiệp Điều Trị đái tháo đường type 2 và ALD
Điều trị bệnh nhân mắc đái tháo đường type 2 và ALD yêu cầu một phương pháp toàn diện và cá nhân hóa, tập trung vào việc kiểm soát các yếu tố nguy cơ và giảm thiểu sự tiến triển của bệnh gan. Một số phương pháp điều trị bao gồm:
Thay đổi lối sống: Điều chỉnh chế độ ăn uống với một thực đơn ít calo, giảm chất béo bão hòa, tinh bột và đường. Ngoài ra, chế độ ăn uống lành mạnh như chế độ ăn Địa Trung Hải có thể cải thiện histology gan, ngay cả khi không giảm cân. Tăng cường hoạt động thể chất giúp duy trì cân nặng và cải thiện sức khỏe tim mạch.
Giảm cân: Giảm ít nhất 5% trọng lượng cơ thể có thể cải thiện đáng kể tình trạng gan nhiễm mỡ, trong khi giảm từ 10% trở lên có thể mang lại lợi ích lớn hơn về mặt cải thiện histology gan và sức khỏe tim mạch.
Dùng thuốc điều trị đái tháo đường type 2: Một số nhóm thuốc như GLP-1 receptor agonists, pioglitazone, và SGLT2 inhibitors đã được chứng minh là có tác dụng giảm mỡ gan, cải thiện kiểm soát đường huyết và giảm nguy cơ bệnh tim mạch ở bệnh nhân T2D và ALD.
Phẫu thuật giảm cân (bariatric surgery): Đây là phương pháp điều trị hiệu quả nhất để giảm cân bền vững. Phẫu thuật này có thể giúp giảm thiểu hoặc cải thiện tình trạng gan nhiễm mỡ, xơ gan và giảm nguy cơ ung thư gan. Ngoài ra, phẫu thuật giảm cân cũng giúp cải thiện các bệnh lý kèm theo như tăng huyết áp và rối loạn lipid máu.
5.3. Mối Liên Quan Của Bệnh Gan Nhiễm Mỡ Không Do Rượu (NAFLD) Với Các Bệnh Khác
Bệnh gan nhiễm mỡ không do rượu (NAFLD) là một tình trạng phổ biến, đặc biệt ở những người mắc bệnh chuyển hóa như đái tháo đường type 2 (T2D), béo phì và các rối loạn lipid máu. Tuy nhiên, ngoài các yếu tố chuyển hóa, gan nhiễm mỡ không do rượu còn có mối quan hệ với một số bệnh lý khác, bao gồm rối loạn nội tiết, bệnh tim mạch và các bệnh khác như hội chứng buồng trứng đa nang (PCOS) và suy giáp. Việc hiểu rõ những mối liên quan này có thể giúp nâng cao hiệu quả điều trị và phòng ngừa các biến chứng nghiêm trọng.
5.3.1. Mối Quan Hệ Giữa gan nhiễm mỡ không do rượu và Hypogonadism (Suy Sinh Dục)
Hypogonadism, đặc trưng bởi sự giảm tiết testosterone và/hoặc suy giảm khả năng sản xuất tinh trùng, có thể ảnh hưởng đến cả nam giới và nữ giới. Trong một số nghiên cứu, mức testosterone thấp đã được liên kết với sự gia tăng mỡ nội tạng, kháng insulin và rối loạn lipid máu. Mặc dù mối liên quan này có thể bị ảnh hưởng bởi béo phì, một nghiên cứu quan sát trên bệnh nhân gan nhiễm mỡ không do rượu cho thấy mức testosterone thấp xuất hiện phổ biến hơn, nhưng mối liên quan này không còn tồn tại khi điều chỉnh cho kháng insulin và béo phì.
Ở nữ giới, chứng suy sinh dục (hypogonadism) ít được nghiên cứu, nhưng một nghiên cứu hồi cứu chỉ ra rằng estrogen có thể là yếu tố bảo vệ chống lại sự tiến triển xơ hóa gan, tuy nhiên tác dụng này giảm dần sau tuổi 50.
5.3.2. Bệnh gan nhiễm mỡ không do rượu và Bệnh Tuyến Giáp
Hormone tuyến giáp có vai trò quan trọng trong nhiều quá trình chuyển hóa, bao gồm phân phối mỡ, sử dụng lipid, tiêu hao năng lượng và cân bằng glucose. Các mức độ bất thường của hormone tuyến giáp và hormone kích thích tuyến giáp (TSH) có thể ảnh hưởng đến gan nhiễm mỡ và mức axit béo tự do. Cả T3 và T4 đều kích hoạt nhiều enzyme dẫn đến tổng hợp axit béo ở gan. TSH cũng tác động lên các thụ thể TSH ở gan, kích thích các con đường PPARα và SREBP-1c, làm tăng gluconeogenesis ở gan.
Mặc dù tỷ lệ mắc suy giáp ở bệnh nhân gan nhiễm mỡ không do rượu có thể dao động từ 15% đến 36%, nhưng mối quan hệ nhân quả giữa hai bệnh này vẫn chưa rõ ràng. Sự nghi ngờ về mối quan hệ này có thể đến từ yếu tố béo phì, vì cả gan nhiễm mỡ không do rượu và suy giáp đều phổ biến ở những người thừa cân. Một nghiên cứu cắt ngang sử dụng kỹ thuật MRI để quan sát mức độ nhiễm mỡ trong gan cho thấy một mối liên hệ nhẹ giữa suy giáp và gan nhiễm mỡ, nhưng không liên quan đến kháng insulin hay các đặc điểm mô học của viêm gan nhiễm mỡ không do rượu.
5.3.3. Bệnh gan nhiễm mỡ không do rượu và Hội Chứng Buồng Trứng Đa Nang (PCOS)
Hội chứng buồng trứng đa nang (PCOS) là một tình trạng nội tiết phổ biến ở phụ nữ, đặc trưng bởi tăng androgen, rối loạn chu kỳ kinh nguyệt và vô sinh. PCOS có liên quan đến nhiều yếu tố nguy cơ tim mạch như béo phì, kháng insulin và gan nhiễm mỡ không do rượu. Khoảng 35% đến 70% phụ nữ mắc PCOS có gan nhiễm mỡ không do rượu.
Một phân tích tổng hợp của 17 nghiên cứu quan sát cho thấy PCOS không phải là yếu tố nguy cơ riêng biệt dẫn đến gan nhiễm mỡ không do rượu, nhưng hyperandrogenism (tăng androgen) có thể là yếu tố đóng góp vào tỷ lệ mắc gan nhiễm mỡ không do rượu cao ở phụ nữ PCOS. Điều này cho thấy, mặc dù PCOS không phải là nguyên nhân trực tiếp gây bệnh gan nhiễm mỡ, nhưng các yếu tố nội tiết đặc trưng của PCOS có thể làm gia tăng nguy cơ mắc NAFLD, đặc biệt là trong bối cảnh kháng insulin và béo phì.
5.3.4. Mối Quan Hệ Với Các Bệnh Chuyển Hóa và Tim Mạch
Bệnh gan nhiễm mỡ không do rượu thường đi kèm với các bệnh lý chuyển hóa khác như đái tháo đường type 2, rối loạn lipid máu và huyết áp cao. Tình trạng kháng insulin ở bệnh nhân NAFLD làm tăng nguy cơ mắc các bệnh chuyển hóa này. Cụ thể, NAFLD là một yếu tố tiên đoán mạnh mẽ của bệnh tim mạch và có thể dẫn đến các biến chứng nghiêm trọng như xơ vữa động mạch, nhồi máu cơ tim và đột quỵ.
Các nghiên cứu cho thấy, điều trị hiệu quả gan nhiễm mỡ không do rượu không chỉ giúp cải thiện tình trạng gan mà còn có thể giảm nguy cơ các biến chứng tim mạch. Bằng cách giảm mỡ gan thông qua thay đổi lối sống, sử dụng thuốc điều trị đái tháo đường type 2 và kiểm soát các yếu tố nguy cơ như huyết áp và cholesterol, bệnh nhân có thể giảm được nguy cơ các biến chứng tim mạch.
Bệnh gan nhiễm mỡ là một tình trạng phổ biến, trong đó mỡ tích tụ trong tế bào gan. Tuy nhiên, có hai loại gan nhiễm mỡ chính: bệnh gan nhiễm mỡ không do rượu (NAFLD) và bệnh gan nhiễm mỡ do rượu (ALD). Mặc dù cả hai đều dẫn đến tích tụ mỡ trong gan, nhưng nguyên nhân, quá trình bệnh lý và cách tiếp cận điều trị của chúng là khác nhau.
6.1. Nguyên Nhân
Bệnh Gan Nhiễm Mỡ Không Do Rượu (NAFLD):
Bệnh gan nhiễm mỡ không do rượu là tình trạng gan bị nhiễm mỡ mà không phải do uống rượu. Các yếu tố nguy cơ chính của gan nhiễm mỡ không do rượu bao gồm:
Béo phì và thừa cân.
Kháng insulin và đái tháo đường type 2.
Rối loạn lipid máu (mức cholesterol và triglyceride cao).
Lối sống ít vận động và chế độ ăn uống không lành mạnh (dầu mỡ, đường, thức ăn chế biến sẵn).
Yếu tố di truyền: Một số người có gen dễ mắc bệnh gan nhiễm mỡ.
Bệnh Gan Nhiễm Mỡ Do Rượu (ALD):
ALD là kết quả của việc tiêu thụ rượu lâu dài và quá mức, dẫn đến tình trạng tích tụ mỡ trong gan. Các yếu tố ảnh hưởng đến sự phát triển ALD bao gồm:
Mức độ và thời gian uống rượu: Uống nhiều rượu trong thời gian dài làm tăng nguy cơ mắc bệnh.
Cơ địa cá nhân: Một số người có cơ địa dễ bị tổn thương gan do rượu.
Các yếu tố khác: Chế độ ăn uống kém, di truyền và bệnh lý gan trước đó có thể làm tăng nguy cơ phát triển ALD.
6.2. Quá Trình Bệnh Lý và Biểu Hiện
Bệnh gan nhiễm mỡ không do rượu:
Đặc điểm: Là sự tích tụ mỡ trong tế bào gan mà không có sự viêm hay tổn thương tế bào gan rõ rệt. Tuy nhiên, nếu không được kiểm soát, gan nhiễm mỡ không do rượu có thể phát triển thành viêm gan nhiễm mỡ không do rượu (NASH) và cuối cùng dẫn đến xơ gan hoặc ung thư gan.
Biểu hiện lâm sàng: Thường không có triệu chứng rõ ràng, nhưng có thể thấy mệt mỏi, khó tiêu, đau hạ sườn phải, và trong một số trường hợp, tăng men gan. Viêm gan nhiễm mỡ không do rượu có thể có các triệu chứng như vàng da, sưng bụng, và dễ chảy máu.
ALD:
Đặc điểm: Tích tụ mỡ trong gan do rượu uống quá mức gây viêm gan, sau đó có thể dẫn đến xơ gan và ung thư gan nếu tiếp tục lạm dụng rượu.
Biểu hiện lâm sàng: Triệu chứng bao gồm mệt mỏi, buồn nôn, sưng bụng, vàng da (vàng mắt), đau bụng vùng gan, có thể xuất hiện các dấu hiệu của xơ gan như chảy máu, dễ bầm tím và thậm chí suy gan.
6.3. Phân Loại và Tiến Triển
Bệnh gan nhiễm mỡ không do rượu:
Ban đầu, gan nhiễm mỡ không do rượu có thể chỉ là sự tích tụ mỡ trong gan mà không có viêm (steatosis). Tuy nhiên, trong một số trường hợp, bệnh có thể phát triển thành NASH (viêm gan nhiễm mỡ không do rượu), có thể dẫn đến xơ gan và cuối cùng là suy gan.
Quá trình tiến triển của gan nhiễm mỡ không do rượu chậm và có thể kéo dài nhiều năm mà không có triệu chứng rõ rệt.
ALD:
ALD có thể tiến triển nhanh hơn và thường bắt đầu với sự tích tụ mỡ trong gan do uống rượu. Nếu tiếp tục uống rượu, bệnh có thể chuyển sang viêm gan do rượu, sau đó là xơ gan do rượu và cuối cùng là ung thư gan.
Tình trạng xơ gan trong ALD có thể phát triển nhanh chóng và nguy hiểm nếu không ngừng uống rượu.
6.4. Điều Trị và Quản Lý
Bệnh gan nhiễm mỡ không do rượu:
Điều trị không dùng thuốc: Tập trung vào thay đổi lối sống, bao gồm giảm cân (5–10% trọng lượng cơ thể), chế độ ăn uống lành mạnh (giảm chất béo bão hòa và đường, tăng cường trái cây, rau và ngũ cốc nguyên hạt), và tăng cường vận động thể chất.
Điều trị thuốc: Các loại thuốc như GLP-1 receptor agonists, pioglitazone và SGLT2 inhibitors có thể được sử dụng trong một số trường hợp để cải thiện mỡ gan và kháng insulin.
Theo dõi: Người bệnh cần được theo dõi định kỳ để phát hiện biến chứng và tiến triển của bệnh.
ALD:
Điều trị chính: Là ngừng uống rượu. Việc loại bỏ rượu khỏi chế độ ăn uống là bước đầu tiên quan trọng nhất trong việc điều trị ALD.
Điều trị hỗ trợ: Nếu có viêm gan hoặc xơ gan, bệnh nhân có thể cần thuốc chống viêm và điều trị các biến chứng như viêm gan và suy gan.
Theo dõi và chăm sóc lâu dài: Bệnh nhân ALD cần theo dõi chức năng gan thường xuyên và có thể cần điều trị thay thế như ghép gan nếu có xơ gan hoặc ung thư gan.
6.5. Dự Báo và Biến Chứng
Bệnh gan nhiễm mỡ không do rượu:
Nếu không được điều trị và kiểm soát, gan nhiễm mỡ không do rượu có thể dẫn đến xơ gan, suy gan và ung thư gan, nhưng tiến triển này thường chậm và không có triệu chứng rõ rệt trong thời gian đầu.
Yếu tố nguy cơ chủ yếu là béo phì, kháng insulin và rối loạn lipid máu.
ALD:
ALD có thể dẫn đến xơ gan, suy gan và ung thư gan nhanh chóng nếu bệnh nhân tiếp tục uống rượu. Việc ngừng uống rượu có thể cải thiện chức năng gan, nhưng một khi xơ gan đã hình thành, tiên lượng thường xấu hơn.
BÀI VIẾT MỚI


































































BACSI ONLINE
Kết nối trực tiếp với các Bác sĩ chuyên khoa hàng đầu
Địa chỉ: HoGuom Plaza, 102 Trần Phú, Hà Đông, Hà Nội, Việt Nam
Điện thoại: 0902247548
Email: suckhoe@bacsi-online.com
Các thông tin trên website Bacsi-Online.com chỉ dành cho mục đích tham khảo, tra cứu và không thay thế cho việc chẩn đoán hoặc điều trị y khoa.
Khuyến nghị Quý khách cần tuyệt đối tuân thủ theo hướng dẫn của Bác sĩ và Nhân viên y tế.
BACSI ONLINE lắng nghe bạn!
Chúng tôi luôn trân trọng và mong đợi nhận được mọi ý kiến đóng góp từ khách hàng để có thể nâng cấp trải nghiệm dịch vụ và sản phẩm tốt hơn!
Hotline: 0902 247 548
Địa chỉ: HoGuom Plaza, 105 Trần Phú, Hà Đông, Hà Nội, Việt Nam
Điện thoại: 0902247548
Email: cskh@bacsi-online.com